
2024年6月19日,深圳大学生命与海洋科学学院张焱特聘教授团队在国际知名学术期刊《The ISME Journal》(中科院1区Top,影响因子:11.0)上发表题为“Asgard archaeal selenoproteome reveals a roadmap for the archaea-to-eukaryote transition of selenocysteine incorporation machinery”的研究论文。
硒是人和许多生物所必需的微量元素,参与生物体的生长、发育和各种重要代谢过程。硒主要通过硒代半胱氨酸(Sec,第21种氨基酸)的形式插入硒蛋白中并发挥各种功能。真核生物的硒蛋白合成机制虽然普遍认为源自古菌,但其中最重要的顺式调控元件—位于硒蛋白mRNA的3'-UTR内的Sec插入序列元件(又称SECIS元件)在真核生物和已知含硒蛋白古菌中完全不同。因此,关于真核生物SECIS元件的起源问题几十年来一直困扰着该领域的研究人员。
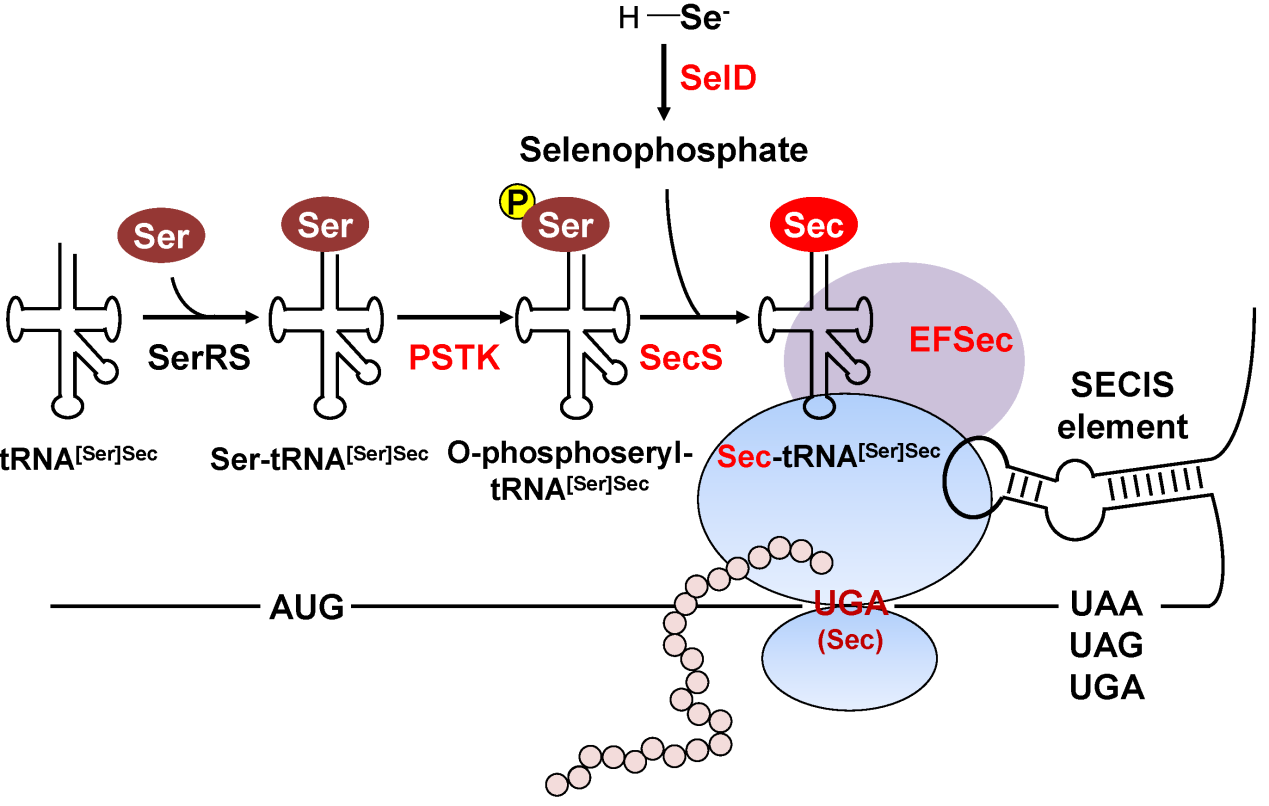
图1. 古菌硒蛋白合成通路示意图。
本研究收集了近年新发现的一类古菌超门—Asgard古菌(真核生物的可能祖先)的数百个物种基因组数据,通过深入分析硒蛋白合成通路和各种硒蛋白家族在这些物种中的分布,发现许多Asgard古菌都可以合成硒蛋白,并且这些硒蛋白基因的SECIS元件几乎都含有类似真核生物SECIS的保守特征,推测很可能是真正的经典古菌SECIS元件。此前发现的含硒蛋白古菌则是通过水平基因转移途径获得了这些经典的古菌SECIS元件,并在环境等因素作用下发生变异而进化出其特有的SECIS结构。真核生物祖先则通过继承Asgard古菌的SECIS并不断优化,逐渐形成现有真核生物的SECIS元件。研究还发现,硒磷酸合成酶(SelD)在古菌-真核生物过渡的过程中发挥了多重功能:它不仅是硒蛋白合成的关键酶之一,而且本身也可以做为硒蛋白来维系硒的利用特性,更为重要的是,该基因的SECIS元件很可能是古菌到真核生物过渡过程中的重要中间体,参与了真核生物祖先SECIS元件的产生。
本研究表明,真核生物硒蛋白合成机制中最为关键的SECIS元件来源于Asgard古菌,并且很可能通过SelD基因的介导而产生并逐渐演化成现在的SECIS结构。该成果填补了关于真核生物和古菌SECIS元件彼此进化关系的理论体系,为深入探索真核生物硒蛋白合成机制的起源及其进化规律提供了重要理论支撑。
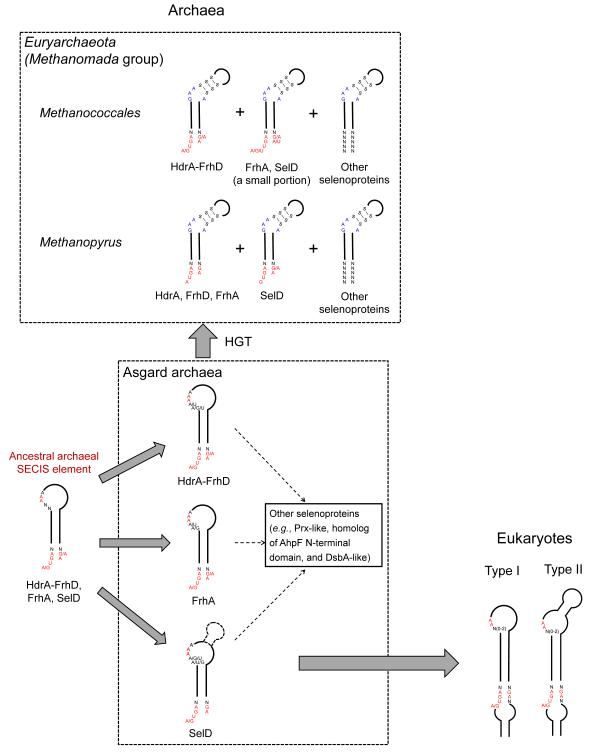
图2. SECIS元件从古菌过渡到真核生物的进化路线图。
深圳大学生命与海洋科学学院的硕士研究生黄碧艳为论文第一作者,张焱教授为论文通讯作者。深圳大学为第一完成单位。该研究得到了国家自然科学基金项目(32270680)和深港脑科学创新研究院项目(2023SHIBS0003)的支持。
文章链接:https://doi.org/10.1093/ismejo/wrae111
生命与海洋科学学院
2024年6月20日


